CRISPR/Cas — одна из наиболее перспективных технологий в области генной инженерии за последние годы. Ученым удалось видоизменить иммунную систему бактерий, для того чтобы вносить точные правки в геном любого организма.
Геном — очень сложная и тонко настроенная система, в которой записана вся информация об организме. Все признаки закодированы в ДНК в виде очень длинной строки из четырех букв A, G, T, C, соответствующих нуклеотидам аденину, гуанину, тимину и цитозину. Например, в человеческом геноме более 6 млрд символов.
Нередко в последовательности нуклеотидов возникают ошибки. Многие из них вызваны вредными воздействиями, которым организм подвергается в течение жизни. Но часть ошибок могут быть врожденными, полученными вместе с неисправной ДНК от кого-то из родителей.
Встроенным системам репарации удается исправить многие ошибки путем сравнения поврежденных участков со здоровыми копиями ДНК. Однако в случае наследственных заболеваний проблема заключается в том, что неисправная ДНК является основной для всего организма.
Обычно лекарства против наследственных болезней не исправляют генетический код, а лишь компенсируют отрицательное проявление болезни. При этом причина многих генетических заболеваний зачастую — всего в одной неправильной букве.
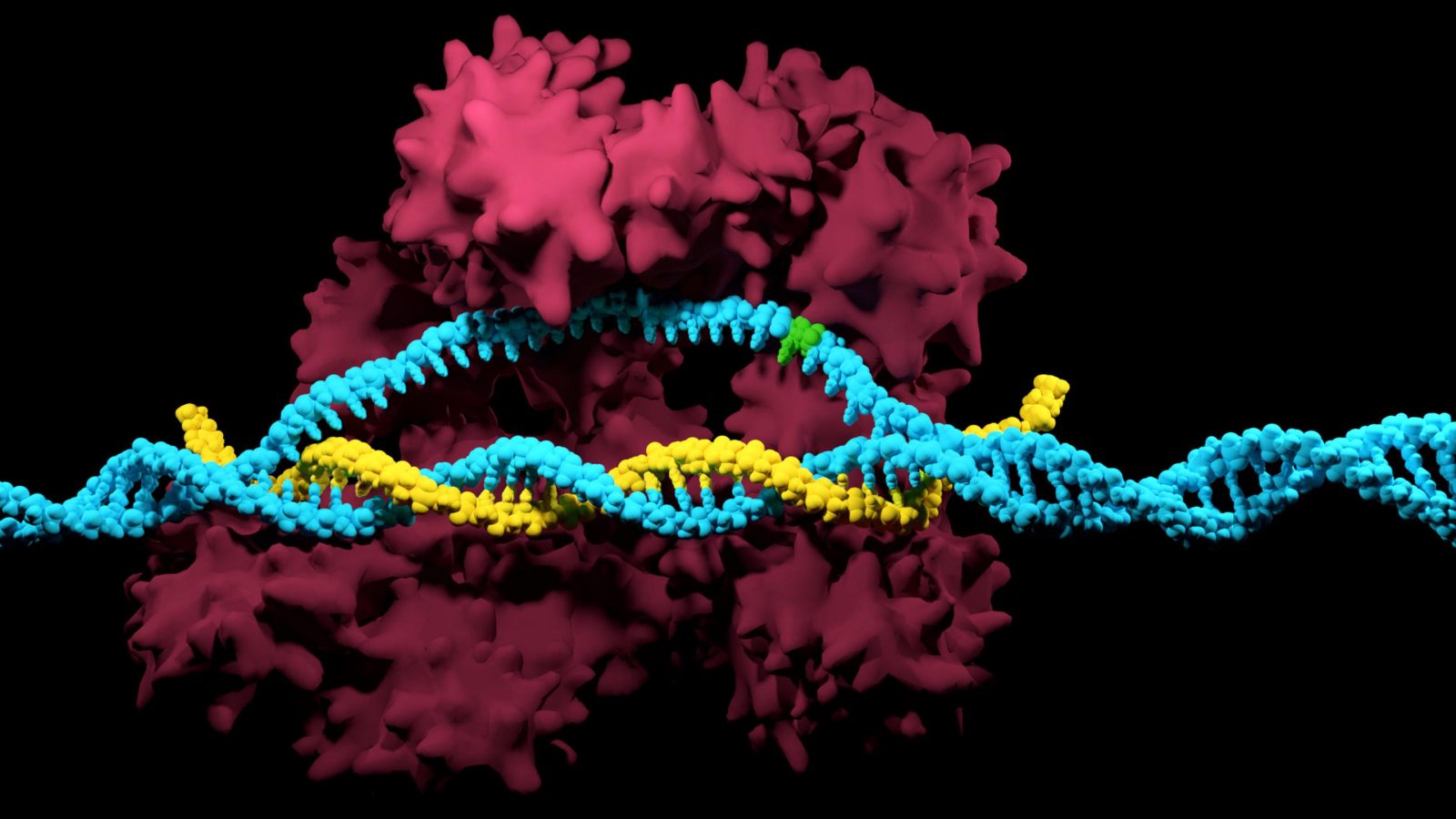
Система CRISPR/Cas основана на иммунной системе бактерий, которая защищает их от вирусов. Ученым удалось усовершенствовать и дополнить природный механизм защиты до потрясающего инструментария, который позволяет достаточно быстро и дешево вносить точные изменения в ДНК растений, животных и людей. При этом замены происходят только в конкретных местах генома и не затрагивают другие его участки.
Разработка CRISPR/Cas
Важной частью системы является специальный участок ДНК, в котором находятся фрагменты вирусных геномов, разделенные одинаковыми небольшими последовательностями нуклеотидов. На основе этих фрагментов клетка синтезирует короткие последовательности, называемые CRISPR-РНК, или РНК-гидами, которые работают подобно антителам человека и теплокровных животных и помогают распознать ДНК вирусов.
Впервые повторяющиеся последовательности, которые впоследствии и получили название CRISPR, обнаружили японские ученые в 1987 году. Однако назначение необычных участков ДНК оставалось неясным, пока в 2007 году микробиологи, работавшие в молочной промышленности, не определили, что это часть иммунной системы бактерий. Тогда же была определена и ключевая роль Cas-белков в защите от вирусов.
Когда в клетку попадает вирусная ДНК, белки Cas9 с прикрепленными РНК-гидами распознают чужеродный генетический материал и разрезают его на фрагменты, часть из которых добавляется в коллекцию между CRISPR-последовательностями, а остальные полностью перерабатываются.
До 2011 года открытие имело только фундаментальную ценность. Но исследование Дженнифер Дудна и Эммануэль Шарпантье показало, что в системе можно подменить РНК-гид на последовательность, соответствующую определенному месту в геноме, в котором необходимо разорвать цепочку.
В начале 2013 года была разработана технология, позволяющая не только разрезать ДНК, но и делать полноценное редактирование. Ученые дополнили систему ферментами для восстановления ДНК.
Технология редактирования открыла широкий простор для практического применения системы. Последние несколько лет количество научных работ, связанных с системой CRISPR/Cas, стремительно растет.
Кроме изначального фермента Cas9 были обнаружены другие представители семейства, например, Cas13 дает возможность редактировать не ДНК, а РНК.
Методы модификации генов существовали и до технологии CRISPR, но низкая точность, долгий и сложный техпроцесс, а также высокая цена не позволяли применять их массово. Стоимость модификации одного гена с помощью CRISPR — всего несколько десятков долларов, а результат готов уже через несколько часов. Еще одно преимущество — абсолютная универсальность для любых организмов.
Исследования на животных
Одна из неизлечимых болезней — миодистрофия Дюшенна (DMD) — привлекла внимание сразу трех групп ученых, работающих с CRISPR.
Миодистрофия связана с дефектами в гене, который кодирует белок дистрофин. Без дистрофина мышечные клетки не могут нормально развиваться, поэтому обычно больные уже в раннем возрасте начинают терять подвижность. Обычно люди с этой болезнью живут меньше 20–30 лет.
Одно из исследований провела группа из Университета Дьюка. Точечное редактирование мутаций у мышей, страдающих DMD, помогло частично восстановить мышечную ткань на 8% от нормы. Это очень хороший результат, так как сохранение даже 4% позволяет продлить жизнь больного.
Параллельно с этим группе из Мичиганского университета удалось смягчить проявления DMD путем редактирования половых клеток мышей. У 80% детенышей, родившихся от пролеченных мышей, отсутствовали наиболее тяжелые формы болезни.
Испытания американских коллег повторила еще одна исследовательская группа из Китая. При этом ученые отметили, что восстановились даже некоторые из мышечных клеток, далеких от места инъекции.
Эксперименты на эмбрионах
Первое применение технологии на человеческих эмбрионах осуществили в 2015 году китайские исследователи. С помощью белка Cas9 и специального РНК-гида они попытались исправить дефект в геноме оплодотворенной человеческой яйцеклетки, который приводил к болезни бета-талассемии.
Тогда технология оказалась недостаточно отлаженной для подобных операций. Мутацию удалось исправить примерно у 5–10% эмбрионов. Но одновременно с этим все эмбрионы получили мутации в других местах генома из-за недостаточной точности РНК-гида или низкой специфичности белка.
В начале 2016 года в Великобритании одобрили генетическую модификацию человеческих эмбрионов в исследовательских целях. Разрешение получила лишь одна группа ученых из Института Фрэнсиса Крика. На исследования отводилось всего 14 дней, после чего эмбрионы было необходимо уничтожить.
В 2017 году американские ученые вместе с коллегами из Кореи и Китая исправили в генах эмбрионов ошибку, которая приводила к гипертрофической кардиомиопатии. Эксперимент оказался более удачным, чем в 2015 году у китайской группы: восстановить геном удалось примерно в 25% случаев.
Осенью 2018 года стало известно о скандальном эксперименте китайского ученого Хэ Цзянькуя, в результате которого родились первые в мире дети с отредактированными генами. По словам исследователя, ему удалось отключить ген CCR5 и сделать эмбрионы невосприимчивыми к ВИЧ.
Вслед за интервью, в котором Хэ Цзянькуй рассказал об эксперименте, последовала жесткая критика за нарушение этических норм, а также законов Китая. Южный научно-технологический университет, в котором работал Хэ Цзянькуй, открестился от любой причастности к эксперименту. В руководстве заявили, что ученый занимался исследованием во время неоплачиваемого отпуска и вне стен института.
После волны общественного осуждения СМИ сообщали об исчезновении Хэ Цзянькуя.
В январе 2019 года появилось официальное подтверждение, что генно-модифицированные девочки-близнецы Лулу и Нана действительно родились, а Хэ Цзянькуй находится под следствием.
Редактирование генома взрослого человека
В 2016 году китайские исследователи впервые отредактировали геном взрослого пациента с раком легких. Для этого ученые взяли собственные Т-лимфоциты больного, изменили их геном, а затем снова ввели в организм.
Новые лимфоциты не содержали ген белка PD-1, который способен подавлять иммунитет. Благодаря исправлению злокачественные клетки потеряли устойчивость к лимфоцитам.
По сути, метод CRISPR в данном случае приходит на смену лечению препаратами на основе антител, которое работает похожим образом, но менее точно и предсказуемо.
Перспективы CRISPR-систем
CRISPR — по-настоящему востребованная и потому популярная тема исследований. За несколько лет количество специалистов, занимающихся этой темой, выросло во много раз, а значит, постепенно будут появляться все более и более отлаженные методики использования этой технологии. Редактирование отдельных нуклеотидов в геноме приближает человечество не только к эффективным способам лечения от тяжелых заболеваний, но и в целом к контролю над организмом на самом тонком уровне.
Кроме применения в сфере здравоохранения, CRISPR имеет огромные перспективы в сельском хозяйстве и проектировании новых антибиотиков.
Если учесть результаты экспериментов на человеческих эмбрионах, то идея создания человека с заданными качествами кажется чуть более реальной. Конечно, подобные методы вызовут жесткие споры в обществе и среди ученых. Однако пока что технология еще не достигла достаточной точности, чтобы полностью исключить побочные мутации, и волноваться еще рано. Некоторые исследования показывают, что количество опасных ошибочных мутаций при использовании CRISPR может достигать 15%.
Поделитесь этим с друзьями!







Будьте первым, кто оставит комментарий
Пожалуйста, авторизируйтесь для возможности комментировать